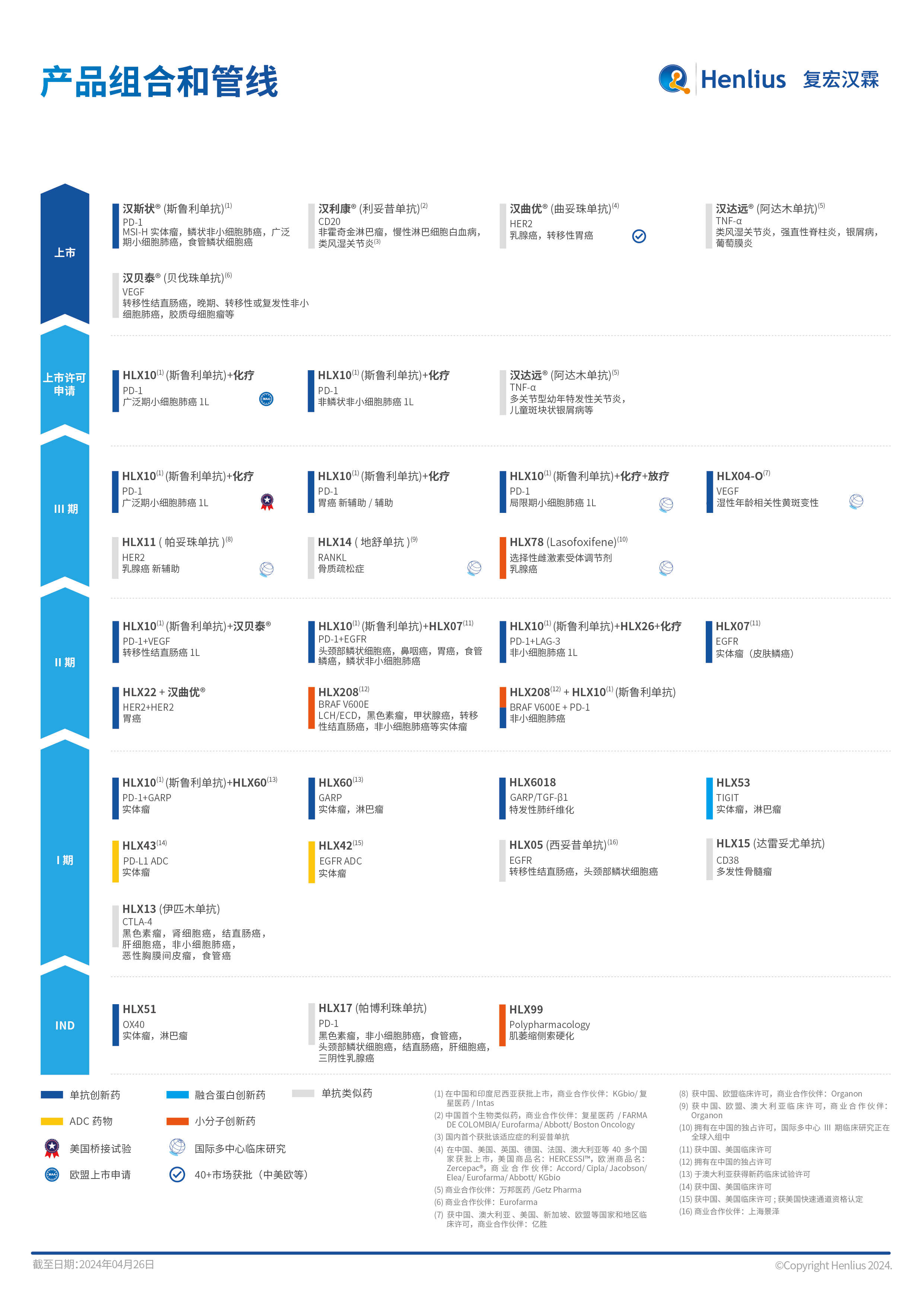
金沙js3777登录入口已在中国上市5款产品,在国际上市2款产品,19项适应症获批,6个上市申请分别获中国NMPA和欧盟EMA受理,16个产品在全球范围内开展30多项临床试验,对外授权全面覆盖欧美主流生物药市场和众多新兴市场。其中,公司首款重磅产品汉利康®(利妥昔单抗)为首个获批上市的国产生物类似药。第二款产品汉曲优®(曲妥珠单抗,美国商品名:HERCESSI™,欧洲商品名:Zercepac®)为中、欧、美三地获批的国产单抗生物类似药,有望为全球HER2阳性乳腺癌和胃癌患者带来更多的治疗选择。2022年3月,公司首个创新型单抗H药汉斯状®(斯鲁利单抗)获批上市,目前可用于治疗微卫星高度不稳定(MSI-H)实体瘤、鳞状非小细胞肺癌、广泛期小细胞肺癌和食管鳞状细胞癌,并成为全球首个获批一线治疗小细胞肺癌的抗PD-1单抗